۴ رهیافت نانوفناوری پزشکی برای مقابله با کووید ۱۹
 ایهگذار علم نانوفناوری پزشکی در ایران با اشاره به تاریخچه بروز و شیوع کرونا ویروس جدید، ضمن تشریح مباحثی از حوزه ویروسشناسی، ویروسهای منشاء اپیدمیهای مختلف در قرن حاضر، انواع گوناگون ویروس کرونا، ساختار ویروس کووید-۱۹ و نحوه اتصال آن به گیرندههای سلولی به عنوان پیشنیاز برای ورود به مبحث راهکارهای قطعی مقابله با ویروس کووید ۱۹، چهار رهیافت متکی بر علوم و فناوری نانو در مقابله با این کرونا ویروس جدید را مطرح کرد.
ایهگذار علم نانوفناوری پزشکی در ایران با اشاره به تاریخچه بروز و شیوع کرونا ویروس جدید، ضمن تشریح مباحثی از حوزه ویروسشناسی، ویروسهای منشاء اپیدمیهای مختلف در قرن حاضر، انواع گوناگون ویروس کرونا، ساختار ویروس کووید-۱۹ و نحوه اتصال آن به گیرندههای سلولی به عنوان پیشنیاز برای ورود به مبحث راهکارهای قطعی مقابله با ویروس کووید ۱۹، چهار رهیافت متکی بر علوم و فناوری نانو در مقابله با این کرونا ویروس جدید را مطرح کرد. به گزارش آوای نشاط، دکتر هاشم رفیعیتبار، عضو فرهنگستان علوم و استاد پیشکسوت گروه فیزیک و مهندسی پزشکی دانشگاه علوم پزشکی شهید بهشتی در پاسخ به سوال طرح شده از سوی خبرگزاری دانشجویان ایران (ایسنا) در رابطه با راهکارهای علوم نانو برای مقابله با پاندمی کووید ۱۹ با نگارش یادداشتی با موضوع "رهیافتهای مقابله با ویروس کرونا-۱۹ با اتکاء بر پزشکی استاندارد و نانوفناوری پزشکی"، با اشاره به تاریخچه بروز و شیوع پاندمی کروناویروس جدید، آورده است: در اوایل آذر ۹۸ اولین شیوع نوعی ذاتالریه بسیار غیرمتعارف، ناشی از ویروس نوظهور کرونا و دارای منشاء انتقالی از حیوان به انسان که بهنام کووید-۱۹ نامگذاری شده، در شهر ووهان در ایالت هوبه چین ظاهر شد و با سرعت بینظیری در تمام کشورهای جهان از جمله ایران باعث بروز پاندمی شد.
جداول زیر موقعیت کشورهای گوناگون، از جمله وضعیت کرونا در ایران را تا ۱۴ خردادماه ۱۳۹۹ نشان میدهند.
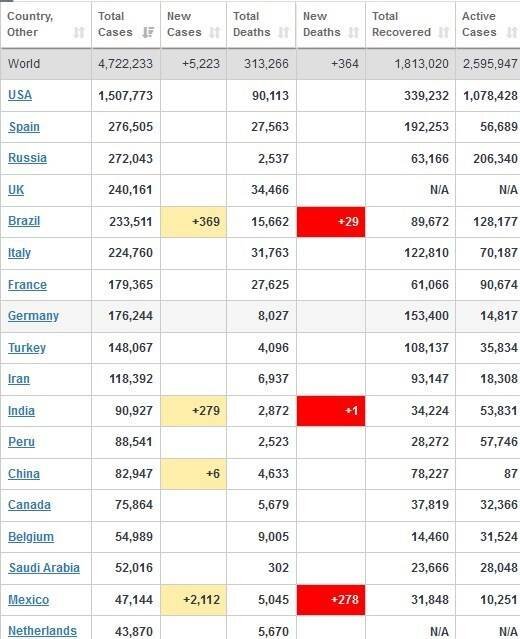
جدول ۱: تعداد مبتلایان، فوتشدگان و بهبودیافتگان در کشورهای مختلف تا هفته سوم اردیبهشت ۱۳۹۹
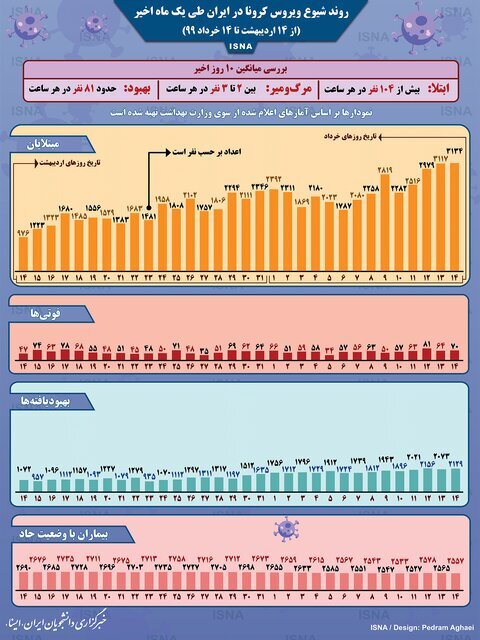
جدول ۲:اینفوگرافیک / روند کرونا در ایران،
از ۱۴ اردیبهشت تا ۱۴ خرداد ۱۳۹۹
(مرجع خبرگزاری ایسنا ۱۴/۳/۱۳۹۹)
بنا به گفته سازمان بهداشت جهانی، تخمین دقیق نرخ ابتلا و فوت ناشی از این بیماری در حال حاضر غیر ممکن است. با این حال کمیسیون سلامت در خود چین طی کنفرانسی نرخ مرگ و میر را ۲.۱ درصد و در ووهان ۴.۹ درصد محاسبه کرده که در بسیاری از کشورها این رقم تغییر کرده است.
در همین راستا قابل ذکر است که در غیاب وجود یک واکسن مختص این بیماری که ممکن است تولید آن بین ۱۸ ماه تا ۲ سال به طول انجامد، راهحلهای گوناگونی جهت مهار این پاندمی پیشنهاد شده که متاسفانه تقریبا قریب به اتفاق این راه حلها که هنوز جوهر پیشنهادات آنها خشک نشده باطل شدهاند، عمدتا استفاده از داروهائیست که برای مقابله با ویروسهای دیگر، یا مشابه ویروس فعلی و یا بهکلی متفاوت با آن، بهکار گرفته شدهاند.
قبل از پرداختن به رهیافتهای پیشنهادی استاندارد مبتنی بر دارو و همچنین پیشنهادات مبتنی بر علوم و فناوری نانو پزشکی در مقابله با ویروس کرونا، باید مباحثی از حوزه ویروس شناسی، ویروسهای منشاء اپیدمیهای مختلف در قرن حاضر، انواع گوناگون ویروس کرونا، ساختار ویروس کووید-۱۹ و نحوه اتصال آن به گیرندههای سلولی مطرح شود.
البته جهت بررسی ساختار و عملکرد ویروس کووید -۱۹، یک شناخت اولیه از موضوع ویروسشناسی ضروری است که در این مورد میتوان به ویکیپدیای فارسی مراجعه کرد.
ویروسهای عامل اپیدمیهای جدید
در خلال بیست سال گذشته، جوامع بینالمللی با انواع گوناگون ویروس مواجه بودهاند: ویروس آنفلوآنزای آووین (یا هنگ کنگی در سال ۱۹۹۷)، ویروس سندرم تنفسی بسیار حاد کرونا سارس (چین سال ۲۰۰۲)، ویروس آنفلوآنزای خوکی (مکزیک سال ۲۰۰۹)، ویروس سندروم تنفسی کرونا مرس در خاورمیانه (عربستان سعودی ۲۰۱۲) و اکنون ویروس کرونا-۱۹ SARS-Cov- (چین سال ۲۰۱۹).
ساختار این ویروسها که توسط میکروسکوپهای الکترونی بهدست آمده، در ذیل آمده است:

شکل ۱: ساختارویروس H5N1 سال ۱۹۹۷
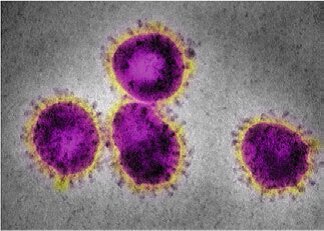
شکل۲: ساختار ویروس سارس سال ۲۰۰۲
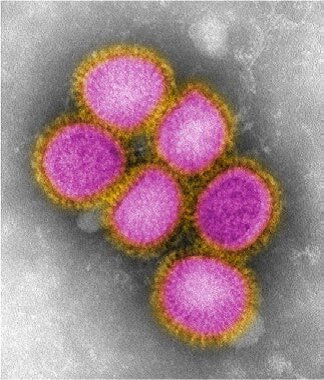
شکل۳: ساختار ویروس H1N1 سال ۲۰۰۹
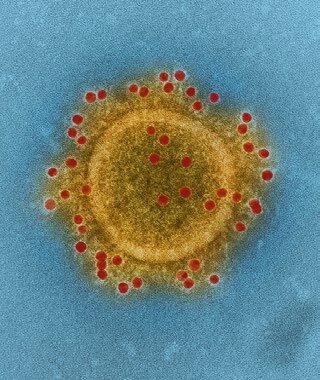
شکل ۴: ساختار ویروس مرس سال ۲۰۱۲
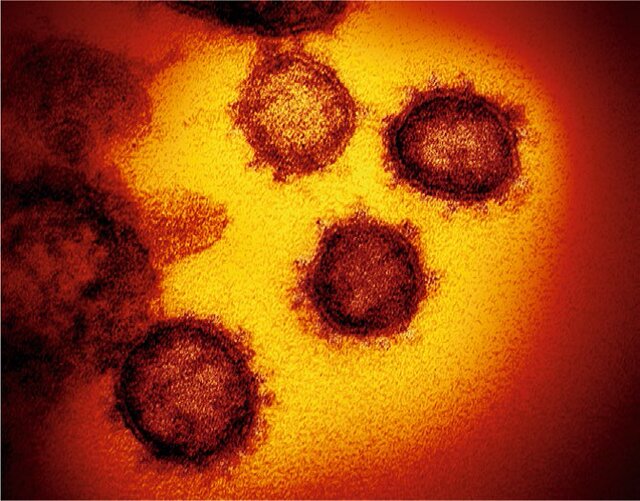
شکل ۵: ساختار ویروس کرونا (کووید ۱۹) سال ۲۰۲۰
تمام این ویروسهای مختلف داری ساختارهای نانومتری هستند
انواع کرونا ویروسها
ویروسهای کرونا (یا کوویدها) که اندازه آنان تا ۲۵۰ نانومتر تخمین زده شده است، متعلق به چهار فامیل هستند: آلفا کرونا، بتا کرونا (که در درجه اول پستانداران را عفونی میکند)، گاما کرونا و دلتا کرونا (که در درجه اول پرندگان را عفونی میکند). در انسانها، ویروسهای کرونا عموما باعث بروز بیماریهای تنفسی فوقانی ضعیف تا حد متوسط، به عنوان مثال شبیه سرماخوردگی متداول، میشوند. بر همین اساس تا پایان سال ۲۰۱۹، چند نوع ویروس کووید انسانی مشخص شده بود که عبارتند از:
- ویروسهای HCoV-NL۶۳, HCoV-۲۲۹ E متعلق به فامیل آلفا کرونا
- ویروسهایHCoV-OC۴۳, HCoV-HKU۱
- ویروس سندروم تنفسی بسیار حاد بهنام سندروم سارس(SARS-Cov)
- ویروس سندروم تنفسی خاورمیانه یا مرس (MERS-Cov) متعلق به فامیل بتا کرونا
دو کووید مرس و سارس بسیار خطرناک بوده و باعث بروز دو اپیدمی گسترده در آغاز قرن بیست و یکم شدند.
در تاریخ هفتم ژانویه ۲۰۱۰، COVID-19 به عنوان هفتمین و جدیدترین نوع ویروس کرونا انسانی به دنیا اعلام شد. این کووید جدید تحت عنوان بتا کرونا-۲ طبقهبندی شده است. تعیین منشاء این ویروس هنوز تحت بررسی است، با این حال شواهد غیرقابل انکار نشاندهنده ارتباط کووید-۱۹ و ویروسهای کرونای شناخته شده، شبیه آنچه در خفاشها موجودند، است. دانشمندان دریافتهاند که این کووید بهطرز تنگاتنگی با دو توالی (سکانس) کووید سارس(SARS-CoV) که در سالهای ۲۰۱۵ و ۲۰۱۷ از خفاشها بهدست آمده، مرتبط است.
فرض بر آن است که یک حیوان نقش بینابینی میزبان را در انتقال این ویروس از خفاش به انسان بازی کرده که نظر به اینکه پستانداران زنده، عموما در بازارهای مواد غذایی در چین بهفروش میرسند، میتوانند باعث شیوع این عفونت انسانی شده باشند.

شکل ۶: مکانیسم انتقال ویروسهای سارس، مرس و کووید -۱۹
(از خفاش به انسان. هنوز میزبان حیوانی اولیه ویروس کووید - ۱۹ روشن نیست)
مکانیسم اتصال ویروس کرونا-۱۹ به گیرندههای سلولی
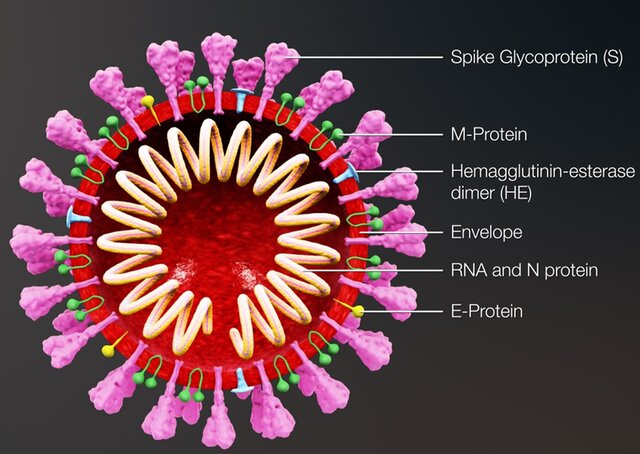
شکل ۷: جرئیات دقیق مولکولی ساختار ویروس کووید ۱۹
توضیح عکس: شاخک گلیکو پروتئین (S) در ویروس کرونا سارس-۲ -(SARS-Cov-2) که در تصویر ۷ مشاهده میشود، ویروس را به گیرنده سلولی بهنام هورمون آنژیوتانسین -۲ (ACE2) متصل میکند. ACE2 بیشتر در مویرگهای ریه یافت میشود. البته ACE2 در سایر نقاط نیز یافت میشود، ولی محل تجمع اصلی آن پوشش آندوتلیوم مویرگهای ریه است. ACE2 یک عامل قوی انقباض عروقی (به خصوص شریانچهها) است. آنزیم ACE2 بخش مرکزی سیستم رنین-آنژیوتانسین که کنترل کننده فشار خون از طریق تنظیم حجم شارهها در بدن است را تشکیل میدهد. مهارکنندههای ACE با کاهش ACE2 باعث کاهش فشار خون در بدن میشوند و با گشاد کردن رگهای خونی، شارش خون را آسانتر کرده و باعث پایین آمدن مقدار آبی که بدن نگه میدارد، میشود که این مساله خود باعث کاهش فشار خون میشود. بر اساس تصویر، هرکدام از گلیکو پروتئینهایی (S) که بر روی غشاء ویروس قرار داشته و نقش اتصال ویروس به گیرنده سلولی را ایفا میکند، از دو واحد (S1) و (S2) تشکیل شدهاند.
واحد اتصال به گیرنده S1 واحد گداخت (فیوژن) S2
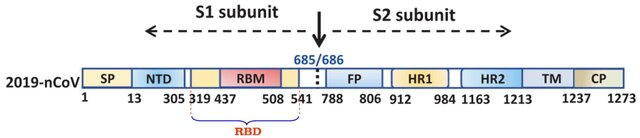
شکل ۸: شکل شماتیک پروتئین S (شاخک) کرونا ویروس ۲۰۱۹ (SARS-CoV-2)
شاخک از دو زیرواحد S1 و S2 تشکیل شده است که در محل اسید آمینههای سرین ۶۸۶ / آرژنین ۶۸۵ قابلیت شکسته شدن را دارد (فلش سیاه). زیرواحد S1 (اسید آمینههای ۶۸۵-۱۴) تا پایانه N (انتهای سمت چپ S1) پروتئین شاخک امتداد دارد و مسئول اتصال به گیرنده سلول میزبان (گیرنده ACE2) است. زیرواحد S1 شامل دامنه پایانه (N (NTD که از اسید آمینههای ۳۰۵-۱۴ تشکیل شده است، دامنه اتصال به گیرنده (RBD)، متشکل از اسید آمینههای ۵۴۱-۳۱۹ و موتیف اتصال به گیرنده (RBM)، متشکل از اسید آمینههای ۵۰۸-۴۳۷ است. موتیف اتصال به گیرنده (RBM) بخشی از دامنه اتصال به گیرنده (receptor-binding domain:RBD) است که به گیرنده ACE2 میزبان متصل میشود. اسید آمینههای شماره ۱۳-۱ سیگنال پپتید (SP) را تشکیل میدهند.
زیرواحدS2 از اسید آمینه سرین ۶۸۶ شروع شده و تا انتهای پروتئین ادامه دارد. این زیرواحد مسئول گداخت (فیوژن: fusion) بوده و در انتقال ویروس به داخل سلول میزبان نقش دارد. زیرواحد S2 شامل پپتید گداخت (FP)، متشکل از اسید آمینههای ۸۰۶-۷۸۸، تکرار هپتادی ۱ (HR1)، حاوی اسید آمینههای ۹۸۴-۹۱۲، تکرار هپتادی ۲ (HR2)، حاوی اسید آمینههای ۱۲۱۳-۱۱۶۳، دامنه فراغشایی (TM) حاوی اسید آمینههای ۱۲۳۷-۱۲۱۴ و دامنه سیتوپلاسمی (CP) است. پپتید گداخت (FP) و تکرارهای هپتادی ۱ و ۲ مسئول گداخت (فیوژن) ویروس به سلول میزبان است. دامنه فرا غشایی در داخل غشای ویروس قرار میگیرد و دامنه سیتوپلاسمی زیر غشاء قرار میگیرد.
برای اطلاع از نوع و توالی اسیدآمینههای متناظر با شمارههای اسید آمینهای ذکر شده در بالا، به فایل FASAT پروتئین شاخک موجود در بانک اطلاعات پروتئین (https://www.rcsb.org) رجوع شود.
مهمترین هدف جهت مبارزه با کووید ۱۹
در ادامه قابل ذکر است که اتصال ویروس به گیرنده سلولی یعنی ACE2 نهایتا به گداخت مابین سلول و غشاء ویروس منجر میشود که راه را برای ورود ویروس به درون سلول باز میکند. اتصال شاخک ویروس به غشاء سلول باعث شکسته شدن واحد S1 شاخک از ریسپتور ACE2 و تحریک واحد S2 ویروس به خروج از حالت شبه متعادل قبل از گداخت به حالت با ثباتتر بعد از گداخت میشود، که این خود برای گداخت ویروس و سلول اساسی است. به نظر میرسد، جهت مبارزه با این ویروس، مهار قطعه RBD جهت اتصال ویروس، مهمترین هدف تلقی شود.
ویروسها با اتکا به خود نمیتوانند تکثیر شوند. برای انجام این باز تولید دو وظیفه عمده دارند: اول ورود به داخل سلول و دوم تبدیل سلول به یک کارخانه بازتولید ویروس بیشتر. ویروسهای نوع کرونا، اطلاعات ژنیتکی خود را در تک رشتههای بلند RNA ذخیره میکنند که در شکل ۷ نشان داده شده است. این رشته RNA با ورود خود به درون سلول، کنترل سلول آلوده شده را جهت تولید اجزائی که برای تکثیر لازم دارد، بهدست میگیرد.
این اجزا عبارتند از پروتئین و RNA. پس از ورود به داخل سلول، انبوهی از RNA ویروس کرونا از طریق کپیسازی تولید میشود. روند کپیسازی در یک محفظه اندوزومی (endosomal compartment) داخل سلول که دارای دو غشاست (که ویروس را از سلول مخفی نگه میدارد)، اتفاق میافتد.
نسل بعدی کروناویروسها چگونه تولید میشوند؟
برخی از کپیهای RNA برای نسل بعدی ویروس، یعنی تکثیر ویروس بستهبندی میشوند. از بقیه کپیها برای دستور دادن به سلول جهت تولید پروتئینهای ویروسی استفاده میشود. این پروتئینها در آن قسمتی از سلول ساخته و پرداخته میشوند که نقش کارخانه و انبار و سیستم تحویل ویروس را بازی میکند. RNA متعلق به ویروس SARS-CoV-2 یکی از بزرگترین ویروسهای RNAدار است.
این ژنوم (ماده ژنتیکی) درست مانند یک mRNA یا RNA پیامرسان (mRNA از یک الگوی DNA رونویسی کرده و اطلاعات را به مکانهای سنتز پروتئین یعنی ریبوزومها، حمل میکند) یک سلول رفتار میکند و باعث هدایت عمل سنتز کردن دو پلی پروتئین طولانی (پروتئینی که شکسته میشود تا تعدادی پلیپتید تولید کند) میشود که شامل ماشینی است که ویروس برای همانندسازی ویروسهای جدید احتیاج دارد.
این پروتئینها شامل دستگاه کپیسازی و خوانش ژنتیکی که RNA بیشتری را تولید میکند و همچنین شامل چندین نوع پروتئین ساختاری که ویریون (virion، ویروس کامل) و دو پروتیز (protease) ) آنزیمی که نرخ شکستن پروتئینها به پلی پپتیدهای کوچکتر را تسریع میکند، میشود. پروتیز اصلی ویروس کرونا یا Mpro که مخفف Main protease است، بیشترین نقش را در این تقسیم پروتئینی ایفا میکند. ساختار بلوری آن تعیین شده و تحت عنوان 6lu7 در دیتا بانک پروتئینها ثبت شده است.
شکل زیر ساختار بلوری Mpro ویروس کرونا را نشان میدهد:
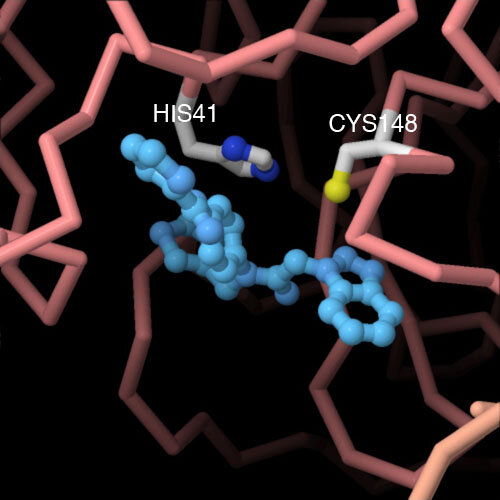
شکل ۹: ساختار بلوری پروتیز ویروس کرونا شامل جایگاه بخش مهارکننده که بر پایه ویروس سارس پیشنهاد شده و با رنگ فیروزهای نشان داده شده است
در حال حاضر، محققان فعالانه از این ساختار Mpro به منظور یافتن ترکیباتی که بتوانند عمل پروتیز را مهار کرده و در واکسن ضد ویروسی بهکار بگیرند، برای پژوهش استفاده میکنند.
راهبردهای مقابله با ویرووس کرونا -۱۹
الف– مقابله دارویی با کرونا-۱۹ تا قبل از کشف واکسن
موسس نانوفناوری پزشکی در ایران در ادامه با اشاره به مهمترین راهبردهای مقابله با ویروس کووید ۱۹، آورده است: در حال حاضر تعداد بسیار زیادی از مواد ضد ویروسی، شامل داروهایی که برای ویروسهای دیگر ساخته شده بودند، بهمنظور ارزیابی اثربخشی آنها در مقابله با این ویروس جدید تحت آزمایش کلینیکی قرار دارند.
راهبردهای مختلف مربوط به ویروسهای سارس و مرس دنبال شدهاند که شامل مهارکنندههای ویروسی و پروتیزهای میزبان میشوند. یکی از اولین داروهای ضد ویروسی که آزمایش شد، داروی ریباویرین بود که نقش مهارکننده RNA را ایفا میکند. این دارو در مورد ویروسهای سارس و مرس بهکار گرفته شده بود، ولی کنش محدودی علیه سارس از خود نشان داده و باعث تخریب چشمگیر سلولهای قرمز خون شد. ریباویرین بهطور معمول همراه با لوپیناویر، ریتوناویر و مهارکنندههای پروتیز HIV بکار گرفته شد. استفاده از انترفرون نیز علائم مثبتی از خود نشان داد.
در همین راستا، نقش اساسی پروتئین S شاخک ویروس کرونا، این گلیکو پروتئین را از اهمیت خاصی برای هدف ضد ویروسی برخوردار میکند، زیرا همانطوریکه گفته شد، این پروتئین راه را برای ورود این ویروس بهداخل سلول همواره کرده و نقش اتصال و گداخت به غشاء سلول را ایفا میکند. در بین عوامل (داروهای دارای مولکول کوچک) که برای بیماریهای ویروسی انسانی مورد تائید قرار گرفته است، داروی کلروکوئین نیز خاصیت مهار کنندهای در مقابله با کرونا نشان داده است.
ب- رهیافتهای متکی بر علوم و فناوری نانو در مقابله با ویروس کرونا-۱۹
برای تشریح این مساله به عنوان مقدمه یادآور میشویم که حیطه تخصصی فناوری نانو، مطالعه و مهندسی ساختارها و دستگاههایی است که در ابعاد فضایی ۱ تا ۱۰۰ نانومتر قرار دارند و در این میان نانو فناوری پزشکی، کاربرد نظریهها، ابزار و پروتکلهای علوم و فناوری عمومی نانو در حیطه تشخیص و درمان پزشکی است.
مطابق برآورد سازمان بهداشت جهانی، اندازه ویروس کرونا-۱۹ در حدود ۰.۲۵ میکرون یا ۲۵۰ نانومتر است. اندازه نانومتری این ویروس آنرا کاندیدای بسیار مناسبی برای استفاده از پروتکلها، ابزار و نظریههای مربوط به علوم و فناوری نانو جهت مقابله با آن میکند.
در همین راستا میتوان چند رهیافت اساسی را در کاربرد نانوفناوری در ارتباط با این ویروس ارائه کرد:
رهیافت اول
راهبرد اول در حقیقت برخورد نانو موادی برای مبارزه با این ویروس است. هدف این راهبرد طراحی، ایجاد و ساخت نانو مواد جهت تولید پوششهای حفاظتی (protective coating) ضدویروسی جهت پوشش دادن لباسهای مخصوص اتاقهای مراقبت پزشکی مانند لباسهای مراقبت ویژه در "آی سی یو"، پوشش بر روی ساختارهایی مانند شیشههای اتاقهای بستری بیمار، دیوارها، دستگیرهها و بهطور خلاصه تمام سطوحی که امکان قرار گرفتن ویروس بر آنها و انتقال ویروس از آنها به انسان موجود است. هدف از ایجاد این پوششهای حفاظتی در قدم اول نه از بین بردن ویروس، بلکه جلوگیری از نشستن آن بر سطوح مختلف است. مطالعات جهانی در این مورد، استفاده از نانوساختارهای در برگیرنده مواد مس، نقره و روی جهت جلوگیری و محدود کردن آلودگی سطوح است. نانو موادی که در رابطه مشخص با ویروس کرونا باشند، هنوز فرموله نشده و اینکه چه ترکیباتی از این مواد و در چه ابعاد و هندسه ساختاری باید در مقابله با این ویروس مورد استفاده قرار بگیرد، یکی از چالشهای بزرگ علم و مهندسی نانو مواد در حال حاضر است.
رهیافت دوم
رهیافت دوم در مقابله با کرونا که بهویژه در ایران تبلیغ میشود و باز هم در حیطه استفاده از نانو مواد قرار دارد، استفاده از خاصیت ضد باکتری برخی از نانو مواد مانند نانو نقره جهت مهار کردن ویروس است. در این میان عمکرد ضدویروسی نانو ذرات فلزی، به عنوان مثال نقره شناخته شده است. این نانو ذره میتواند به عنوان مهار کننده باز تولید ویروس نیز عمل کند. بهعنوان مثال، نانو نقره میتواند از ورود ویروس HIV-1 به داخل سلول جلوگیری کند. همچنین نانو ذرات طلا که توسط پلیمرهای زیست سازگار پایدار شدهاند، از خود خاصیت ضد ویروسی علیه HIV-1 و برخی از آنفلوآنزاها مانند H1N1, H3N2, H5N1 نشان دادهاند. استفاده از نانولولههای کربنی تک جداره نیز بهمثابه حاملین مواد ضد ویروسی مطرح شدهاند. بهعنوان مثال، استفاده از نانو لوله کربنی برای حمل ریباویرین. البته استفاده از نانو ذرات جهت مهار کردن ویروس کرونا هنوز بهطور عملی ارائه نشده و میتواند مبحث مهمی در پژوهش این مساله باشد.
رهیافت سوم
رهیافت سوم طراحی و ساخت حسگرهای فوق حساس با استفاده از ساختارهای مقیاس نانو جهت یافتن ویروس است. این حسگرها میتوانند به تشخیص بسیار سریع ویروس کرونا منتهی شوند. ساخت این حسگرهایهای فوقالعاده حساس و دقیق مستلزم استفاده از پیشرفتهترین دستاوردهای علم و مهندسی نانو الکترونیک، علم مواد و مهندسی در مقیاس نانو است. تصویر ۱۰ نمونه یکی از این حسگرها که دارای ابعاد ۱۰۰ x ۱۰۰ میکرو متر مربع بوده و حسگر ترانزیستور گسل میدانی (field emission transistor: FET) است و در کره جنوبی ساخته شده را نشان میدهد.
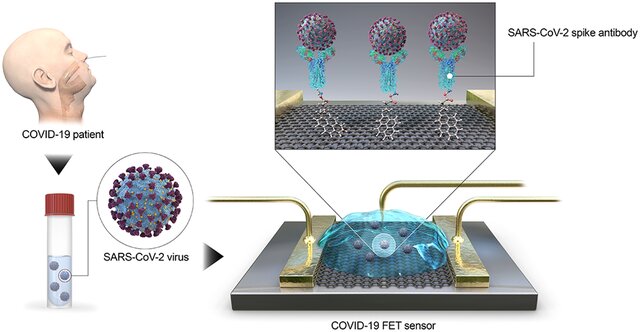
شکل ۱۰: حسگر ترانزیستور گسل میدانی جهت تشخیص ویروس کرونا-۱۹
از گرافن بهعنوان ماده حس کننده استفاده شده و آنتی بادی شاخک ویروس (رنگ فیروزهای) با استفاده از اسید پایرنبیوتیریک N هیدروکسی ساکینی مید استر بهعنوان اتصالدهنده به صفحه گرافن متصل شده است. ویروس از مخاط بینی گرفته شده و بر روی آنتیبادی نشانده میشود.
مرجع (ACS NANO, April ۱۵, ۲۰۲۰, https://dx.doi.org/۱۰.۱۰۲۱/acsnano.۰c۰۲۸۲۳ )
نتایج نشان میدهند که این حسگر قادر است نسبت به حضور مقادیر بسیار ناچیز ویروس در حد چند فمتو گرم در میلی لیتر fgr/ml (یعنی ۱۰ به توان منفی پانزده گرم در میلی لیتر) از خود پاسخ الکتریکی نشان دهد.
رهیافت چهارم
این رهیافت بیشتر به جنبه علوم نانو مرتبط میشود. هدف آن، تحلیل نظری و مدلسازی و شبیهسازی وابسته به کامپیوتر در ارتباط با ساختار و عملکرد خود ویروس کرونا-۱۹ در مقیاسهای مولکولی، اتمی و یا زیر اتمی با استفاده از روشهای بسیار پیشرفته مکانیک آماری محاسباتی در علوم نانو و روشهای پیشرفته مکانیک کوانتومی و یا روشهای چند مقیاسی متکی بر ترکیبی از روشهای میکروسکپیک و نانو سکپیک است.
در اینجا تمرکز بهعنوان مثال، میتواند بر روی بررسی ویروس و بهویژه ساختار و عملکرد شاخک آن و چگونگی اعمال متغیرهای ترمودینامیکی جهت ایجاد اختلال در ساختار و عملکرد پروتئین S باشد. یکی دیگر از زمینههای پژوهشی در این رهیافت مدلسازی دقیق پروتیز این بیماری و بررسی مولکولهای زیستی است که میتوانند نقش مهارکننده این پروتئین را ایفا کنند.
پیشنهاداتی در سطح کلان برای مهار سریعتر اپیدمی کرونا
دکتر رفیعی تبار، عضو فرهنگستان علوم (شاخه فیزیک و ریاضی) در بخش انتهایی این یادداشت با اشاره به مصاحبهای که ۷ اسفند ۹۸ منتشر شده، آورده است: اکنون که ستاد مقابله با بیماری کرونا ایجاد شده، باید با یک زبان و با یک استراتژی مدون و از پیش تعیینشده، با امواج مخرب این بیماری مواجه شد و تنها به نصحیت درباره اجرای پروتکلهای بهداشتی بسنده نشود و مانند بسیاری کشورها از نیروهای اجرایی در اعمال این پروتکلها در سطح عام جامعه کمک گرفته شود.
باید در نظر داشت که به احتمال زیاد این ویروس تا مدتهای زیاد در جوامع، یا بهصورت آشکار و یا نهفته، وجود خواهد داشت و نظر به اینکه مورفولوژی آن در طول زمان میتواند دچار تغییرات ساختاری و حتی پرشی شود، پس عملکرد و شیوه بروز آن نیز میتواند دچار تغییرات جدی شود. سبک زندگی در جوامع بشری بعد از کرونا با سبک زندگی قبل از کرونا بسیار متفاوت خواهد بود. باید در کشور، خود را و زندگی روزمره خود، فعالیتهای تحصیلی و اقتصادی را با این شرایط جدید تغییر داده و دمساز کنیم. نقش جامعه پزشکی کشور در این مدت بسیار چشمگیر بوده و واقعا همگی مدیون آنها و کادر درمان هستیم. بهترین قدردانی از زحمات شبانهروزی این عزیزان رعایت کامل پروتکلهای بهداشتی، به حداقل رسانیدن تماسها و ترددهای غیرضروری است.
کرونا را فقط با یک برخورد همهجانبه علمی، داشتن یک استراتژی مدون، مدلسازی شرایط اشاعه و اتخاذ تصمیمات قاطع در سطح جامعه میتوان شکست داد.
انتهای پیام/
